vol. 4 3/2015 Inżynier i Fizyk Medyczny
148
radioterapia
\
radiotherapy
artykuł naukowy
\
scientific paper
Wprowadzenie
W ciągu ostatnich dekad obserwowano silny rozwój technik napro-
mieniania pacjentów. Nowe, dynamiczne techniki leczenia pozwo-
liły uzyskać skomplikowane kształty izodoz, które lepiej odwzoro-
wują złożone kształty obszarów tarczowych. Uzyskano możliwość
jednoczasowego napromieniania kilku obszarów terapeutycznych
różnymi wartościami dawek SIB (
Simulated Integrated Boost
) oraz
lepszej kontroli dawki w narządach krytycznych [1-2].
Rozwój techniki o modulowanej intensywności dawki IMRT (
In-
tensity Modulated Radiotherapy
) przyczynił się do powstania i reali-
zacji koncepcji napromieniania „nieskończoną” ilością wiązek, czy-
li do objętościowej terapii łukowej VMAT (
Volumetric Arc Therapy
).
W obu technikach, w porównaniu do konwencjonalnych planów
leczenia, liczba wiązek terapeutycznych tzw. beamletów uległa
zwiększeniu. Małe rozmiary i skomplikowane kształty apertur
realizowanych przez listki kolimatora MLC (
MultiLeaf Collimator
)
wymusiły konieczność wprowadzenia nowych narzędzi do wery-
fikacji dozymetrycznej indywidualnych planów pacjentów [3-5].
Z punktu widzenia rozdzielczości przestrzennej detektora za
najlepszą metodę pomiaru pól o złożonej geometrii uważa się fil-
my dozymetryczne. Jednak ze względu na skomplikowany proces
obróbki oraz wysokie koszty nie są one obecnie rutynowo stoso-
wane. Powszechnie użytkowane są detektory elektroniczne, tj.
płaskie matryce wielodetektorowe oraz fantomy do pomiarów
w geometrii przestrzennej, w których jako detektory promienio-
wania wykorzystuje się komory jonizacyjne lub półprzewodniki.
Możliwe jest równieżwykonywanie pomiarówza pomocą płaskich
matryc przytwierdzonych do głowicy aparatu terapeutycznego.
W wielu ośrodkach radioterapeutycznych wdrożono pomiary
weryfikacyjne dynamicznych planów leczenia przed rozpoczę-
ciem lub niedługo po rozpoczęciu terapii pacjenta, jako jeden
z etapów kontroli jakości [3-6]. Umożliwiło to ocenę sprawności
aparatu, transferu informacji z Systemu Planowania Leczenia
(SPL) do systemu zarządzania terapią, wykonalności planu na apa-
racie terapeutycznym oraz weryfikację rozkładu i wartości dawki.
Dozymetryczna weryfikacja dynamicznych planów leczenia
została wpisana do wykazu wzorcowych procedur radiologicz-
nych z zakresu radioterapii onkologicznej [7] i jest wymagana
podczas wykonywania procedur teleradioterapii konformalnej
z zastosowaniem techniki modulacji intensywności dawki (CR-
T-IMRT) oraz teleradioterapii sterowanej obrazem (IGRT) i te-
leradioterapii radykalnej z planowaniem 3D, jeśli planowanie
uwzględnia użycie technik dynamicznych. Sposoby i zasady pro-
wadzenia indywidualnej kontroli jakości leczenia zostały opisane
w międzynarodowych dokumentach AAPM [3] oraz ESTRO [5].
Cel opracowania
Celem pracy było wdrożenie metod pomiarowych kontroli ja-
kości indywidualnych planów leczenia w technice dynamicznej
VMAT z użyciem: płaskiej wielodetektorowej matrycy komór jo-
nizacyjnych IBA MatriXX (IBA, Niemcy), cylindrycznego fantomu
ArcCheck (Sun Nuclear, USA) oraz punktowych pomiarów komo-
rą jonizacyjną typu Farmer (PTW, Niemcy).
Przeprowadzone pomiary były jednym z elementówweryfika-
cji dozymetrycznej systemu planowania leczenia Monaco v.3.3
(Elekta, Szwecja) przed wdrożeniem do klinicznego użytkowania
w Uniwersyteckim Szpitalu Dziecięcym w Krakowie.
Materiał i metoda
Przygotowano 17 planów w technice VMAT, w tym dla nowo-
tworów z regionu głowy i szyi (
Head&Neck
–
H&N
) (4), klatki
piersiowej (7), jamy brzusznej (3) oraz miednicy (3), w SPL Mo-
naco v.3.3, zgodnie ze zleceniem lekarza specjalisty w dziedzinie
radioterapii i zaleceniami raportu ICRU 83. Plany leczenia były
optymalizowane przy pomocy algorytmu Monte Carlo dla wiąz-
ki fotonowej o energii 6 MeV, dla której izocentrum znajdowało
się w środku obszaru PTV lub w środku geometrycznym sumy
obszarów PTV. Wiązka składała się z dwóch łuków realizowanych
zgodnie (pierwszy łuk) i przeciwnie (drugi łuk) do kierunku ruchu
wskazówek zegara. Zakres kątów łuków wybierany był arbitral-
nie przez fizyka planującego leczenie w zależności od umiejsco-
wienia obszaru PTV w ciele pacjenta. Parametry optymalizacji
planów leczenia dobierane były indywidualnie, tak, aby spełnić
kryteria zlecenia lekarskiego na napromieniane obszary PTV
oraz narządy krytyczne. Obliczenia wykonywano dla siatki kal-
kulacyjnej 3 mm x 3 mm x 3 mm z uwzględnieniem niejednorod-
ności z odchyleniem standardowym (SD) 0,5% na plan.
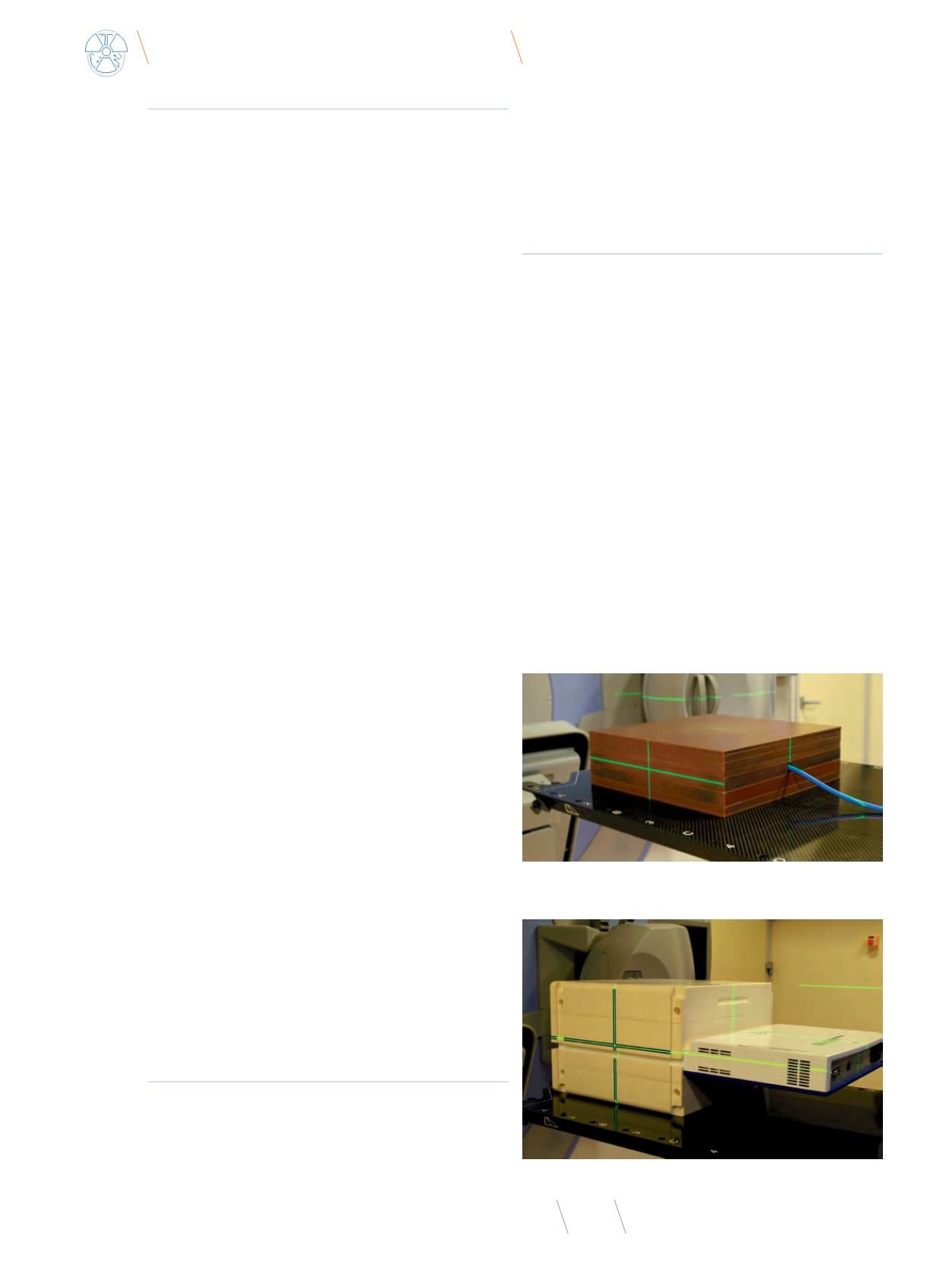
Fot. 1
. Układ pomiarowy: komora typu Farmer umieszczona w fantomie płytowym
Virtual Water, punkt pomiaru w izocentrum
Fot. 2
. Układ pomiarowy: matryca IBA MatriXX umieszczona w fantomie MultiCube


