Inżynier i Fizyk Medyczny 4/2016 vol. 5
193
radioterapia
/
radiotherapy
artykuł naukowy
/
scientific paper
są to dawki frakcyjne znacznie powyżej 10 Gy, zakłada się, że nie
podaje się więcej niż 5 frakcji. Z radiobiologii wynika (Rys. 1), że
dawka jednorazowa niszczy więcej komórek niż ta sama wartość
dawki podzielona na dawki frakcyjne [7, 8].
Ta sama zależność występuje dla komórek zdrowych, które ota-
czają guz nowotworowy. Zastosowanie takiego schematu napro-
mieniania, mała liczba frakcji i wysokie dawki frakcyjne powodują,
że prawdopodobieństwo miejscowego wyleczenia będzie większe
niż w przypadku „klasycznego” frakcjonowania dawki. Dlaczego
tak się dzieje? Ponieważ w czasie pomiędzy frakcjami komórki no-
wotworowe nie przestają się dzielić, a w ostatnim etapie leczenia
szybkość podziału nawet się zwiększa! Jeżeli pomiędzy frakcjami
przerwa jest zbyt duża, wówczas może dojść do sytuacji, że liczba
komórek nowotworowych będzie się zwiększać, pomimo prowa-
dzonej radioterapii. Czyli duża dawka frakcyjna powinna być sku-
teczniejsza, z terapeutycznego punktu widzenia, i rzeczywiście
jest. Niestety ograniczeniem jej wielkości są tkanki zdrowe, które
otaczają guz nowotworowy. Na rysunku 2 przedstawiono krzywe
prawdopodobieństwa miejscowego wyleczenia (TCP) i powikłań
(NTCP). Im przesunięcie tych krzywych względem
siebie jest większe, tym lepiej. Nie mamy wpływu
na biologię (nie potrafimy zwiększyć promienio-
oporności tkanek zdrowych), zatem musimy dążyć
do zmniejszenia dawki w ich objętościach.
Dlaczego VMAT?
Rozważania dozymetryczne
Zmniejszenie dawki w tkankach zdrowych stało
się możliwe dzięki wprowadzeniu do praktyki kli-
nicznej technik dynamicznych, miało to miejsce
w latach dziewięćdziesiątych ubiegłego wieku
(IMRT). W tym samym czasie pojawił się akcelera-
tor, który zupełnie zmienił „filozofię” planowania
leczenia i realizację radioterapii – CyberKnife [13].
Z obowiązku należy wspomnieć o GammaKnife – aparacie wyko-
rzystującym źródła kobaltowe (izotop 60 kobaltu) [9, 10]. Aparat
ten doskonale nadaje się do napromieniania małych zmian w mó-
zgu. Kolejnym urządzeniem, które doskonale łączyło dwa roz-
wiązania techniczne (tomograf komputerowy i akcelerator bio-
medyczny), to tomoterapia [16]. W pierwszej dekadzie XXI wieku
wprowadzono do praktyki klinicznej dynamiczną technikę łukową
VMAT (
Volumetric Modulated Arc Therapy
). Wszystkie te techniki
zostały opracowane w celu zmniejszenia dawki w tkankach zdro-
wych. Spełniają one zatem warunek, który wymagany jest w ra-
diochirurgii i można je wszystkie z powodzeniem stosować w celu
podania dużej dawki w bardzo małym obszarze. Jeżeli w technice
VMAT stosuje się wiązki bez filtra spłaszczającego, można wyko-
rzystywać maksymalną moc dawki 24 Gy/min dla wiązki fotono-
wej X-10MV (akcelerator TrueBeam firmy Varian Medical System).
Tak duża moc dawki (klasyczna frakcjonowana radioterapia sto-
suje moce dawek rzędu 2-3 Gy/min) znacząco skraca czas trwania
seansu terapeutycznego, co powoduje, że ruchomość intrafrak-
cyjna jest minimalna. W przypadku podawania dużych dawek
frakcyjnych, w jednej lub kilku frakcjach jest to bardzo istotne.
W radiochirurgii błąd geograficzny popełniony w czasie jednej
frakcji ma zdecydowanie większy wpływ na powodzenie leczenia
niż w klasycznie frakcjonowanym schemacie. Przykład, załóżmy,
że popełniamy 5% błąd geograficzny (lokalizacji) w jednej frak-
cji, co przekłada się w przypadku radiochirurgii i dawki frakcyjnej
10 Gy na błąd podania dawki rzędu 0,5 Gy. Podczas gdy dla 60 Gy
podanych w 30 frakcjach (dawka frakcyjna 2 Gy) różnica w dawce
(5% * 2Gy) wynosi 0,1 Gy! (na frakcję), w stosunku do 60 Gy daje to
0,17% różnicy. Stąd wniosek, że w radiochirurgii weryfikacja uło-
żenia chorego, zgodności dawki obliczonej z podaną oraz realiza-
cji leczenia musi być prowadzona na kilka możliwych sposobów.
Ocena zgodności dawki
obliczonej i realizowanej
Obliczony rozkład dawki musi zostać sprawdzony przed roz-
poczęciem terapii [23]. W podstawowej metodzie weryfikacji
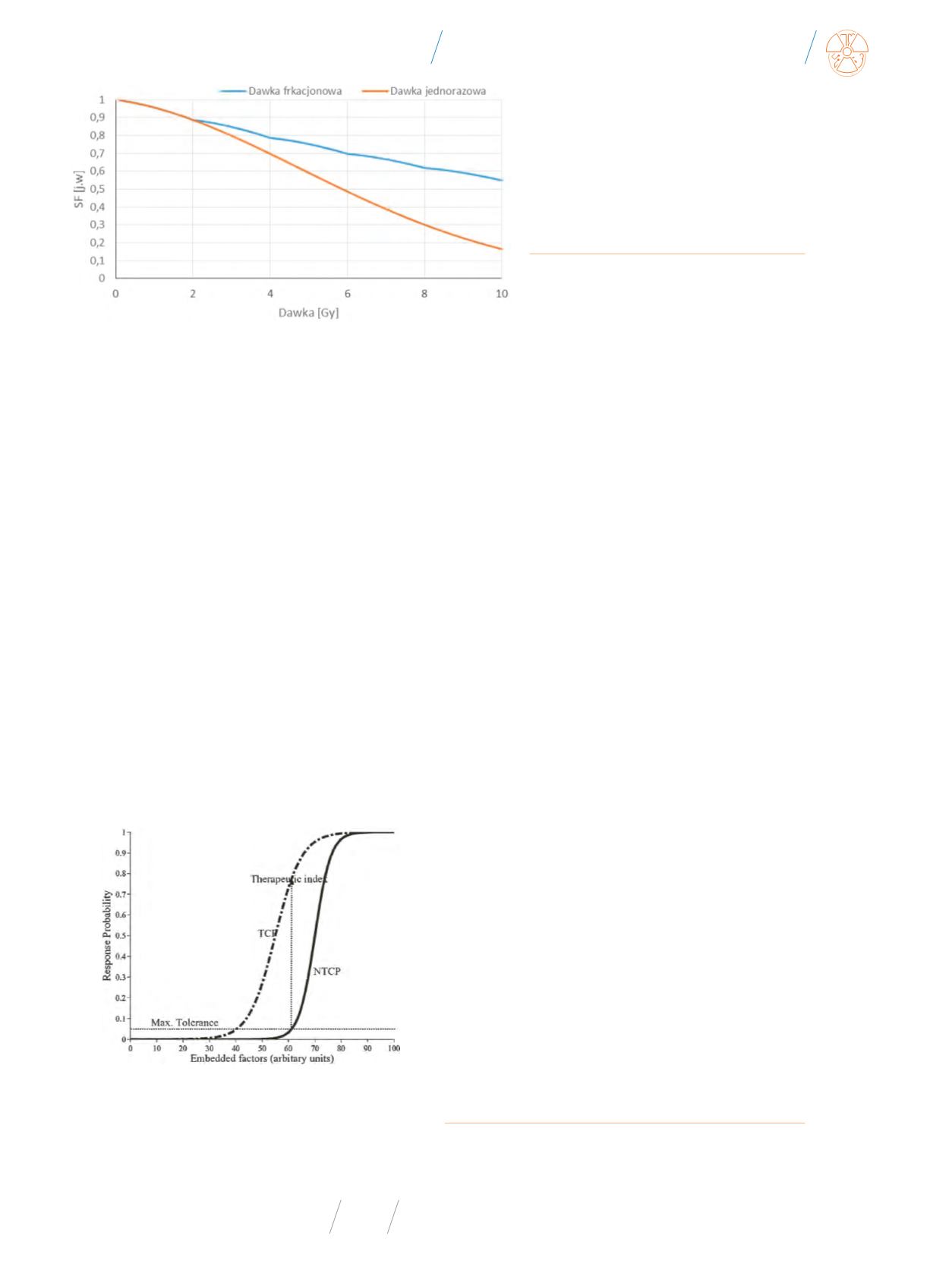
Rys. 1
Frakcja komórek SF (survival fraction) przeżywających dawkę promieniowania: jednorazową
oraz frakcjonowaną. Z obliczeń wynika, że podanie jednorazowej dawki 10 Gy przeżywa 15% początko-
wej liczby komórek, podczas gdy ta sama dawka podana w frakcjach dwugrejowych powoduje przeży-
cie 55% początkowej liczby komórek. Oczywiście wykres przedstawia wartości przykładowe, niezwią-
zane z konkretną linią komórek
Rys. 2
Przykładowe krzywe prawdopodobieństwa miejscowego wyleczenia TCP
(tumor control probability) oraz powikłań popromiennych NTCP (normal tissue com-
plication probabilty) [1]. Wykres przedstawia przykładowe dane, tzn. podanie dawki
60 [Gy] spowoduje prawdopodobieństwo powikłań w tkankach zdrowych na pozio-
mie 5% (wielkość akceptowalna), równocześnie prawdopodobieństwo miejscowego
wyleczenia (TCP) wynosi 80%. Jeżeli zwiększymy dawkę do 70 Gy, wówczas NTCP
wzrośnie do 70% – wartość nie do zaakceptowania, a TCP wzrośnie do 95%


