vol. 6 6/2017 Inżynier i Fizyk Medyczny
346
wydarzenia
\
events
Przygotowanie pacjenta.
Protokół stosowany w Centrum Onkologii – Instytucie, Od-
dziale w Gliwicach (COI Gliwice) oparty jest głównie na [4] i służy
do leczenia szpiczaka mnogiego po tandemowym przeszczepie
szpiku od dawcy. Standardowo każdy pacjent jest unieruchamia-
ny za pomocą czterech unieruchomień termoplastycznych na
zestawie dedykowanych podpórek (Fot. 1).
Tomografia komputerowa
Wykonywane jest badanie tomografii komputerowej (CT), na
podstawie którego powstaje plan leczenia. Pacjent jest unie-
ruchamiany w pozycji terapeutycznej i skanowany w orientacji
głową do aparatu na swobodnym oddechu. Zakres skanów obej-
muje całe ciało. Skany są rekonstruowane co 0,5 cm.
Objętość PTV oraz narządy krytyczne
Jako PTV wrysowywane są kości z wyłączeniem kości dłoni, żu-
chwy i twarzoczaszki. Do kości długich dodawany jest pięciomi-
limetrowy margines, ze względu na ich możliwe ruchy. Organy
krytyczne to: mózgowie, soczewki oczu, jama ustna, płuca, ser-
ce, wątroba, nerki, jelita oraz pęcherz moczowy.
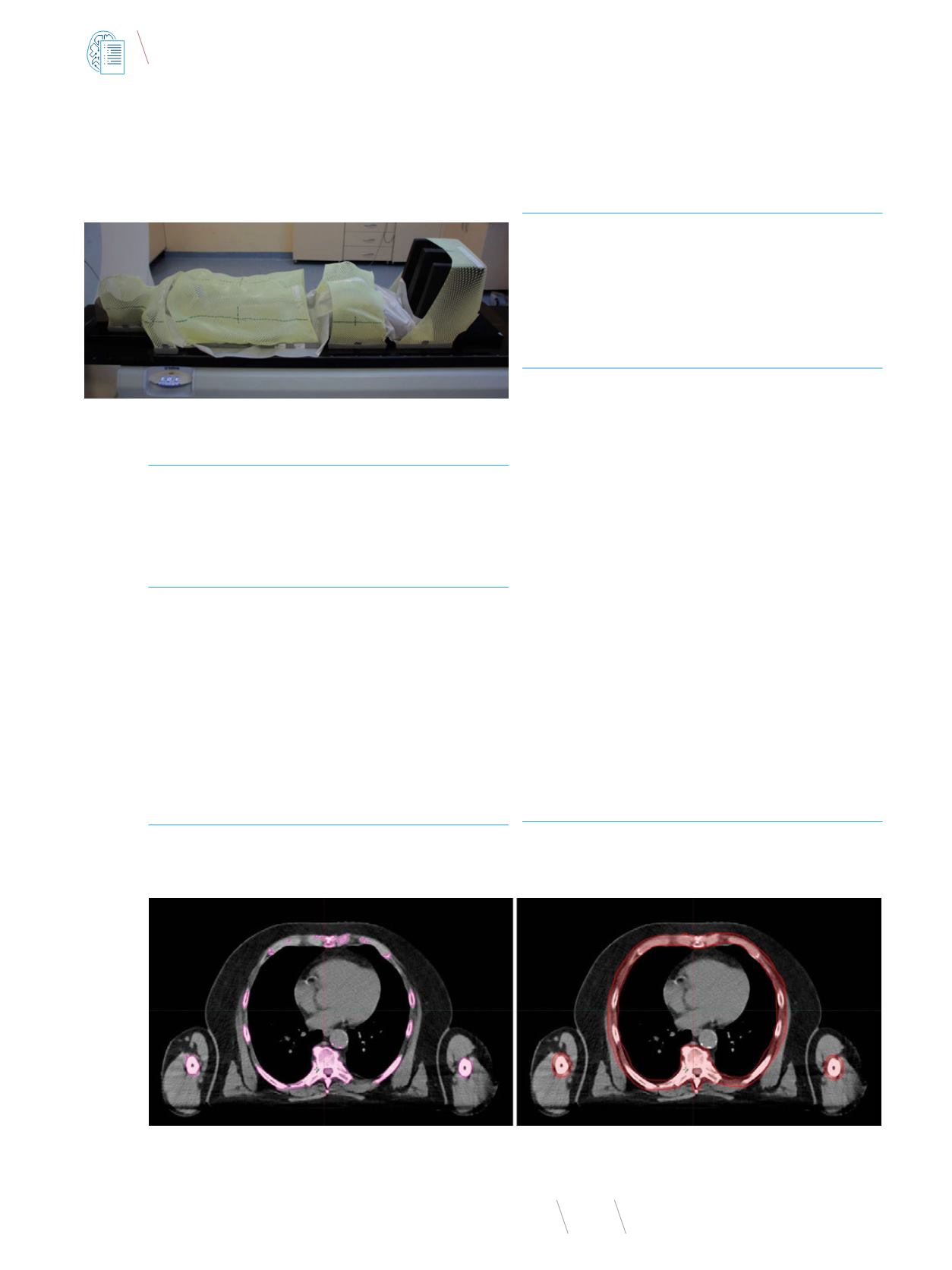
Kości klatki piersiowej łączy się w pojedynczą strukturę (Fot.
2) w celu kompensacji zmian położenia pojedynczych żeber pod-
czas seansu terapeutycznego. Pacjent podczas napromieniania
oddycha swobodnie. Blisko położone kości mogą zostać łączo-
ne, aby uprościć problem optymalizacji, ale tylko wtedy, gdy nie
wpływa to negatywnie na dawki uzyskane w organach krytycz-
nych.
Frakcjonowanie i normalizacja
Standardowo podawana jest dawka całkowita 12 Gy w dawkach
frakcyjnych po 4 Gy. W przypadku stwierdzenia istnienia ak-
tywnych zmian w badaniu PET stosuje się dodatkowy boost do
dawki 24 Gy w dawkach frakcyjnych po 4 Gy tylko na te aktywne
zmiany. W zależności od lokalizacji aktywnego ogniska stosuje
się technikę dynamiczną (VMAT, IMRT) lub statyczną (3D-CRT).
Normalizacja rozkładu dawki zapewnia, iż 85% objętości targetu
pokrywa 99% zadanej dawki.
Aparaty
Dla każdego pacjenta przygotowuje się plany na dwa rodzaje
akceleratorów. Domyślną techniką jest tomoterapia (Accuray,
Sunnyvale, CA, USA), równocześnie z planem na tomoterapię
jest przygotowywany plan na akcelerator klasyczny: Clinac 2300
(VarianMedical Systems, PaloAlto, CA, USA) z kolimatorem Mil-
lenium 120. Kolimator ten pozwala na uzyskanie maksymalnego
pola promieniowania 31x40 cm
2
w izocentrum.
Tomoterapia
Wykonuje się dwa plany dla każdego pacjenta. Pierwszy obej-
muje objętość PTV od czubka głowy do mniej więcej połowy
ud, w zależności od wysokości pacjenta i jest on realizowany
w ułożeniu pacjenta głową w stronę aparatu. Drugi plan służy do
napromieniowania kończyn dolnych pacjenta i jest realizowany
przy ułożeniu pacjenta nogami w stronę aparatu. Takie postę-
powanie jest konieczne ze względu na ograniczenia techniczne
przesuwu stołu do 130 cm. Plany te różną się też zastosowaną
techniką. Wplanie do napromieniania kończyn dolnych wykorzy-
stuje się dwie boczne wiązki naprzeciwległe. Jest to tak zwana
technika TomoDirect. Plan dla głowy i tułowia jest realizowany
jako napromienianie z wykorzystaniem techniki helikalnej
.
Stan-
dardowa siatka do obliczeń rozkładu dawki ma rozdzielczość
0,254 x 0,254 cm.
Do weryfikacji ułożenia pacjenta korzysta się z dwu sekwen-
cji MVCT: jednej dla regionu głowy pacjenta, drugiej w okolicy
miednicy. Osobno weryfikowana jest pozycja odwrócona przed
napromienianiem kończyn dolnych pacjenta.
Kontrola jakości planu jest trójelementowa. Za pomocą dwu
komór jonizacyjnych określa się dawkę w okolicy lędźwiowej
i kończyn dolnych pacjenta, a przy użyciu matrycy detektorów
i fantomu Octavius (PTW, Freiburg, Niemcy) mierzy się rozkład
dawki dla głowy pacjenta. Przyjęte kryteria akceptacji rozkładu
dawki w obliczeniach współczynnika gamma to 3%/3 mm przy
90% progu liczby punktów spełniających kryterium.
Technika VMAT
Pacjent – podobnie jak przy planach TT – jest napromieniany
w dwóch położeniach, a objętość PTV początkowo dzielona jest
w okolicy ud. Dodatkowo, aby móc skuteczniej przeprowadzić
Fot. 1
Zestaw dedykowanych podpórek wraz z czterema maskami termoplastycznymi służącymi
do unieruchomienia pacjenta
Fot. 2
Przykład łączenia struktur uzyskanych dzięki automatycznemu konturowaniu kości (lewa strona) w większe struktury (prawa strona). Na prawym rysunku widoczny
jest dodatkowy margines dodany do konturu kości długich kończyny górnej


