Inżynier i Fizyk Medyczny 1/2015 vol. 4
31
radioterapia
/
radiotherapy
artykuł naukowy
/
scientific paper
Rys. 3
. Obszar narastania dawki wraz z głębokością oddziaływanego ośrodka.
W obszarze buildup umieszczona jest zmiana nowotworowa. Z
max
odpowiada głę-
bokości, na której deponowana jest dawka maksymalna zależna od rodzaju i energii
promieniowania jonizującego. Z
o
odpowiada powierzchni na skórze pacjenta. W tej
sytuacji zmiana nowotworowa otrzymywałaby ok. 50-60% przypisanej dawki.
też zaplanowany rozkład dawki w systemie planowania leczenia
przy pomocy odpowiednich algorytmów symulujących zjawiska
oddziaływania, wymaga weryfikacji z jej rzeczywistym rozkła-
dem w ciele pacjenta.
Odpowiedzią na ilość zaabsorbowanej energii promieniowa-
nia może być ilość nowo powstałego polimeru wytworzonego
z monomeru w pewnej objętości czynnej, umieszczonego na
drodze terapeutycznej wiązki promieniowania.
Polimeryzacja jest zjawiskiem wieloetapowym, w którym jed-
nym z etapów jest zainicjowanie reakcji. Ponieważ w radioterapii
takim inicjatoremmoże być promieniowanie jonizujące, zjawisko
polimeryzacji zostało wykorzystane w konstrukcji dozymetru
ilości dawki pochłoniętej – dozymetru żelowego [14-16].
Dozymetr jest fantomem pacjenta, w którym objętość czyn-
ną stanowi matryca i rozpuszczone w niej monomery. Pod wpły-
wem promieniowania monomery ulegają polimeryzacji i siecio-
waniu, tworząc usieciowane struktury polimerowe (Rys. 5).
Rys. 4
. Obszar narastania dawki zmodyfikowany bolusem. O grubości bolusa decy-
duje wielkość obszaru buildup, który z kolei zależy od rodzaju i energii promieniowa-
nia jonizującego. W tej sytuacji zmiana nowotworowa otrzymywałby dawkę rzędu
95-100% przypisanej dawki.
Materiał polimerowy powinien posiadać właściwości tkanko-
podobne, ww. odpowiednią gęstość czy ze względu na odzia-
ływanie efektu Comptona – porównywalną liczbę elektronów
z molekułą tkanki. Co ważne, materiał powinien mieć również
odpowiednie właściwości fizyko-chemiczne pozwalające na
sprawne modelowanie go na skórze pacjenta, jak i właściwości
mechaniczne decydujące o trwałości struktury.
Ponieważ PCL posiada tego rodzaju właściwości, znalazł za-
stosowanie również w tej aplikacji radioterapeutycznej. W tym
przypadku również wykorzystywano termoplastyczny PCL
w formie granulatu. Granulki polimeru pod wpływem obróbki
cieplnej wiążą się ze sobą, tworząc zbitą i jednolitą strukturę
o grubości zdeterminowanej przez energię i rodzaj promienio-
wania. Pod wpływem ciepła polimer staje się bardziej plastycz-
ny, co pozwala na jego łatwe modelowanie i dopasowanie do
struktur anatomicznych bądź wypełnienia nim nierówności czy
jam ciała pacjenta, np. jamy nosowej czy małżowiny usznej, dzię-
ki czemu mamy możliwość pozbycia się przestrzeni powietrz-
nych na drodze wiązki – „niekontrolowanemu” rozproszeniu
elektronów i możliwości otrzymania bardziej jednorodnej dawki
wokół zmiany.
Dozymetria promieniowania
Oddziaływanie promieniowania jonizującego z materią – ciałem
człowieka jest opisywane metodami statystycznymi. Dlatego
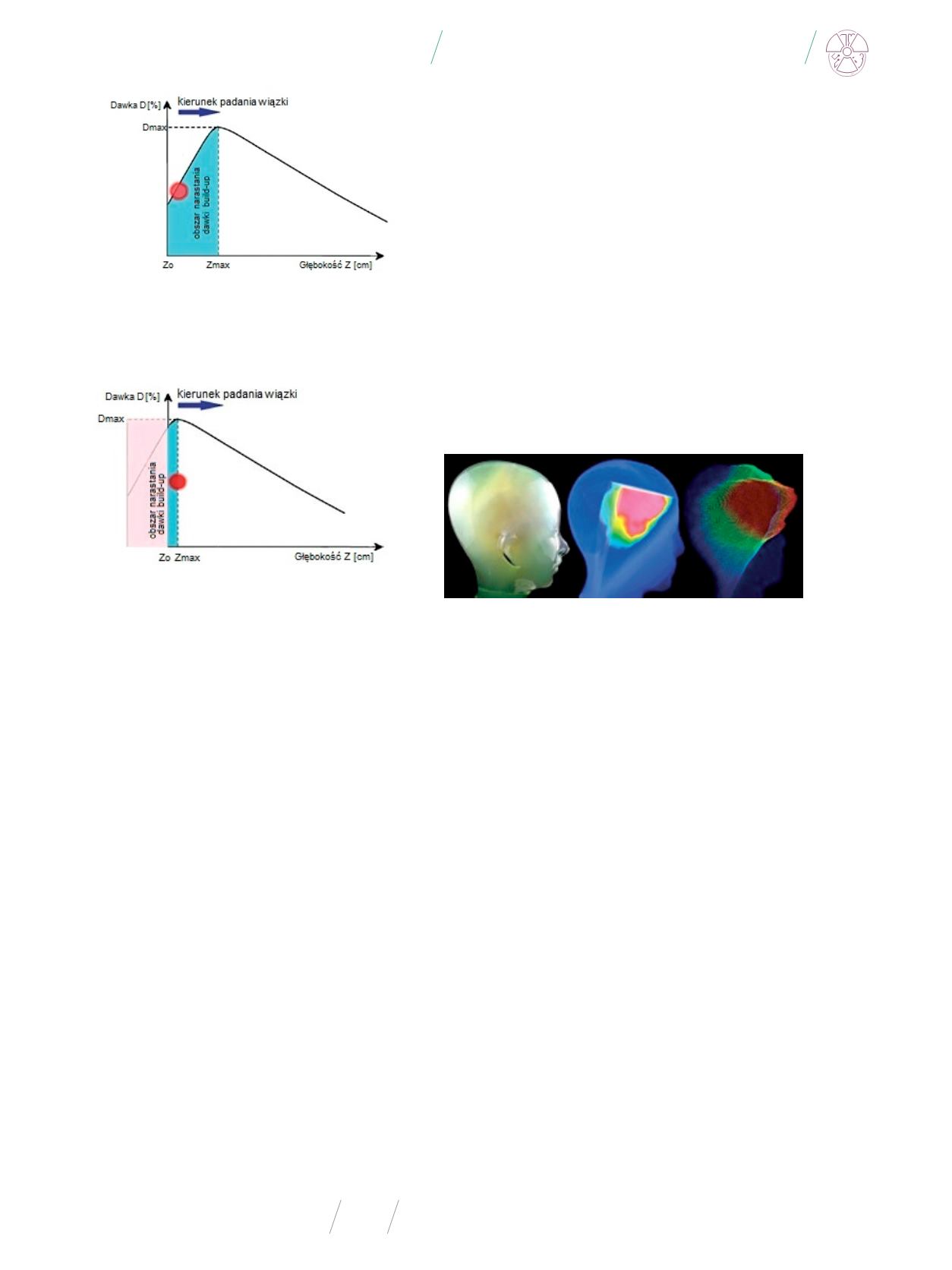
Rys. 5
. Dozymetr żelowy po napromienieniu (pierwszy z lewej) oraz wizualizacja 3D
zaabsorbowanej dawki (środkowy i pierwszy z prawej)
Źródło: D.SC., Ph.D. Marek Kozicki.
Ponieważ usieciowane struktury polimerowe odbijają światło
widzialne, skumulowana dawka promieniowania jest widzialna
w jego objętości czynnej, jednak rozkład jej wartości można oce-
nić dopiero przy użyciu jądrowego (najczęściej protonowego)
rezonansu magnetycznego. Odczytany w ten sposób rozkład
dawki odpowiada wartości czasów relaksacji spin-spin, który
następnie przetworzony, porównywany jest z dawką otrzymaną
w systemie planowania leczenia.
Najczęściej używanym monomerem do tego rodzaju aplikacji
jest monomer dwuwinylowy N,N-metylenobisakryloamid [17].
Monomer pod wpływem promieniowania jonizującego ulega po-
limeryzacji z powstaniem usieciowanego hydrożelu stanowiące-
go niemalże wierne środowisko imitujące masę ciała człowieka.
Promieniowanie jonizujące nie jest w tym przypadku jedynym
inicjatorem [14, 15, 18]. Cechą dozymetru jest jego duża roz-
dzielczość, która jest bardzo pożądana przy weryfikacji rozkła-
du dawki z planem leczenia, jednak wadą ograniczenie czasowe
związane z czasem odczytu informacji z dozymetru.
W pozostawionym dozymetrze, pod wpływem temperatury,
w części czynnej mogą zachodzić kolejne reakcje polimeryzacji
prowadzące do utraty informacji o rozkładzie dawki, dlatego
istotną rolę odgrywają warunki przechowywania dozymetru
i dostępność jądrowego rezonansu magnetycznego.
Zastosowanie zjawiska polimeryzacji w dozymetrii pro-
mieniowania jonizującego, nie zawsze jest jednak efektem


