vol. 5 6/2016 Inżynier i Fizyk Medyczny
324
diagnostyka
\
diagnostics
artykuł naukowy
\
scientific paper
Obecność techniki
1
H MRS w medycynie rozpoczęła się od
jej zastosowań w badaniach mózgu – ze względu na dużą ho-
mogeniczność tkankową tego organu, ograniczone artefakty
ruchowe oraz możliwość uzyskania dodatkowej wiedzy diagno-
stycznej bez konieczności ingerencji chirurgicznej – ta odmiana
spektroskopii nosi nazwę neurospektroskopii. Szereg prac na-
ukowych z ostatnich lat pokazuje, jak skuteczne może być wyko-
rzystanie spektroskopii protonowej w onkologii [1-6], pediatrii
[7] oraz neurologii [8].
Jednakże metoda ta ciągle nie może zaistnieć na szeroką ska-
lę w diagnostyce klinicznej, głównie z powodu złożonego cha-
rakteru widma spektroskopowego – co wynika z superpozycji
sygnałów, szumu i artefaktów aparaturowych. Ponadto analiza
widm
1
H MRS nadal jest czasochłonna, a interpretacja i przypi-
sanie otrzymanych wyników do konkretnych stanów klinicznych
nastręcza wiele trudności.
Aby uzyskane dane spektroskopowe pozwalały na ocenę ilo-
ściową, akwizycja i analiza widm MRS muszą spełniać określone
standardy jakościowe [9-12]. W pracowniach MR wykonujących
spektroskopię rezonansu magnetycznego, oprócz standardo-
wych testów MR konieczne są testy kontroli jakości dedykowa-
ne dla MRS. Ich częstotliwość zależy od liczby badań – testy nie
powinny być jednak rzadsze niż raz w miesiącu. Niestety nie ma
formalnych zaleceń dotyczących procedur kontroli jakości obo-
wiązujących dla techniki
1
H MRS. Jedyne wymaganie prawne
dotyczy obecności fizyka (obecność fizyka jest narzucana Roz-
porządzeniemMinistra Zdrowia z dnia 6 listopada 2013 r. w spra-
wie świadczeń gwarantowanych z zakresu ambulatoryjnej opie-
ki specjalistycznej [Dz.U. 2013 poz. 1413]).
Punktem wyjścia dla własnego systemu QC (
Quality Control
)
mogą być procedury opracowane przez amerykańskich fizyków
medycznych zrzeszonych w
American Association of Physicists in
Medicine
i przedstawione w raportach [9, 13].
W przypadku badań
1
H MRS szczególnie wysokie są wyma-
gania dotyczące jednorodności pola magnetycznego. Dlatego
ważnym elementem systemu nadzoru nad jakością badań
1
H
MRS są testy fantomowe. Pozwalają one uniknąć błędów ilościo-
wych w badaniach
in vivo
.
Celem tej pracy jest przedstawienie podstawowych procedur
kontroli jakości przygotowujących urządzenie MR do badania
MRS oraz procedur weryfikacji oznaczeń ilościowych.
Techniki lokalizacyjne
i sekwencje pomiarowe
w spektroskopii
1
H MRS
Spektroskopowe techniki lokalizacyjne dzielą się na metody
pojedynczego woksela (ang.
single voxel
, SV), polegające na
rejestracji widma
1
H MRS z pojedynczego obszaru (objętości)
zainteresowania ROI (
Region Of Interest
) lub VOI (
Volume Of In-
terest
), oraz metody obrazowania przesunięcia chemicznego
(ang.
Chemical Shift Imaging
, CSI), które dają możliwość akwizycji
widm z wielu obszarów jednocześnie. Widma rejestrowane przy
użyciu metody SV charakteryzują się lepszą jakością – ze wzglę-
du na większą efektywność optymalizacji pola magnetycznego
dla małych objętości pomiarowych (ok. 1-10 cm
3
) niż w przypad-
ku techniki CSI, w której obszar pomiarowy jest znacznie większy
(powyżej 50 cm
3
). Zaletą drugiej metody jest natomiast możli-
wość przestrzennej oceny procesów metabolicznych. Jako me-
todę ilościową pomiaru stosuje się zatem metodę SVS. Z kolei
technika obrazowania przesunięcia chemicznego (2D lub 3D CSI)
będzie bardziej przydatna na przykład w przypadku planowania
radioterapii [14].
W niniejszej pracy została wykorzystana technika SV i se-
kwencja lokalizacyjna PRESS (
Point Resolved Spectroscopy
). Na
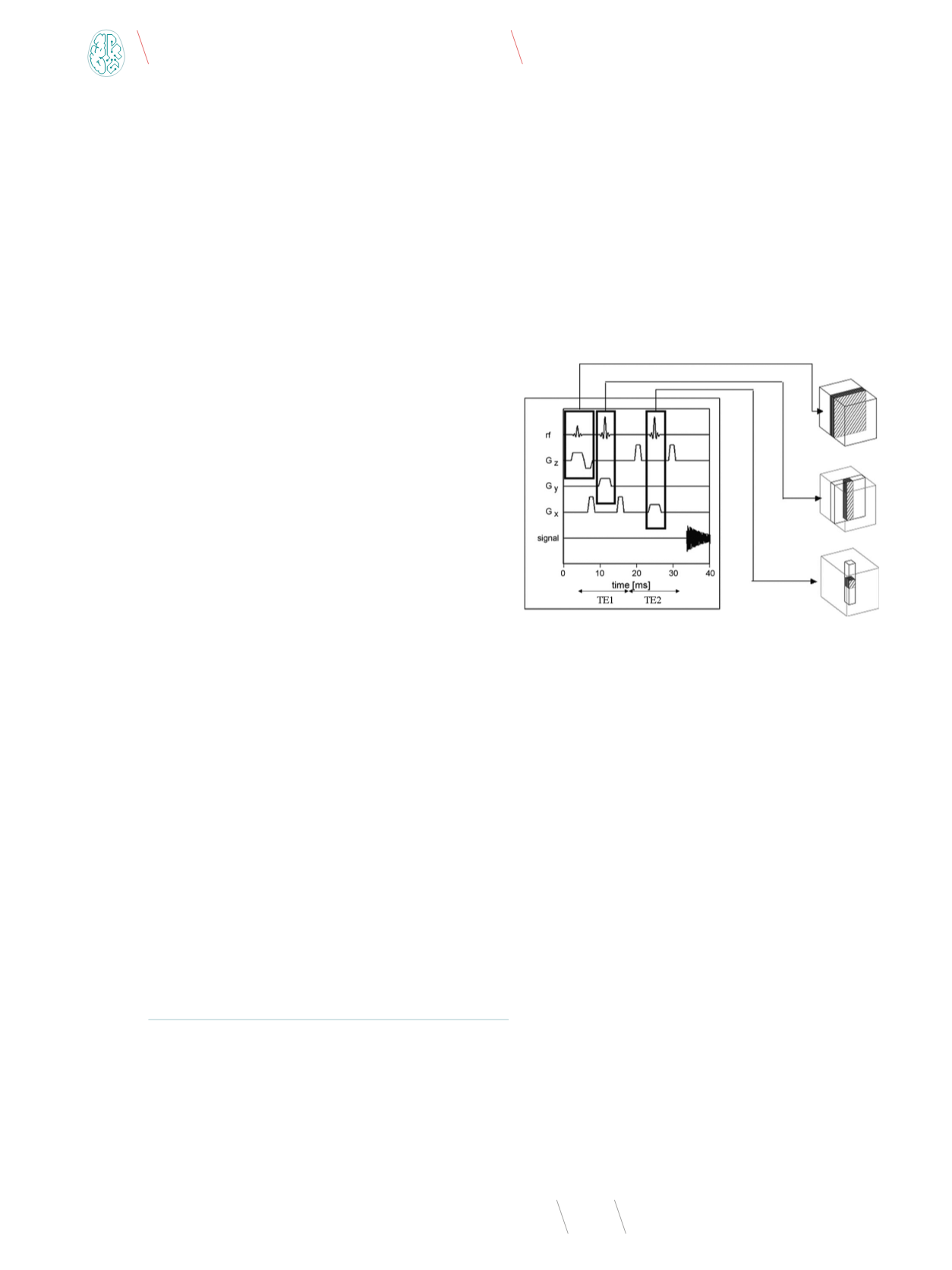
rysunku 1 przedstawiono schemat tej sekwencji [15].
Rys. 1
. Sekwencja impulsowa PRESS
Źródło: [15].
Sekwencja PRESS składa się z trzech impulsów 90
o
-180
o
-180
o
podawanych wraz z odpowiednimi impulsami gradientowymi.
Sygnał echa spinowego, który jest generowany po pierwszym
z impulsów 180
o
, nie jest rejestrowany. Zastosowanie kolej-
nego impulsu 180° (wraz z gradientem G
z
wzbudzającym war-
stwę w płaszczyźnie
yz
) ostatecznie definiuje objętość pomia-
rową jako objętość na przecięciu warstw
xy
,
xz
i
yz
. Po czasie
TE = TE1+TE2 generowany i rejestrowany jest sygnał właściwego
echa spinowego. Czas między impulsem 90° a właściwym sygna-
łem echa spinowego określa się czasem echa (ang.
echo time
,
TE), a czas między kolejnymi impulsami 90° jest nazywany cza-
sem repetycji (ang.
repetition time
, TR).
Modyfikacja pasma częstotliwości impulsów oraz wartości
centralnej tego pasma pozwala na zmianę objętości pomiarowej
oraz dowolną lokalizację obszaru zainteresowania względem
izocentrum skanera. Zmieniając natomiast odstępy czasowe
(TE1 i TE2) między impulsami RF (
Radio Frequency
) częstotliwo-
ści radiowej można dokonać filtracji występujących wwidmie sy-
gnałów metabolitów ze względu na czas relaksacji poprzecznej
(T2). Stopień relaksacji podłużnej dla grup funkcyjnych metabo-
litów można modyfikować przez zmianę TR.
W związku z tym, że tkankowe stężenia metabolitów są około
1000 razy niższe od stężenia wody w tkankach, aby możliwe było
obserwowanie sygnałów metabolitów w widmach
1
H MRS, se-
kwencje pomiarowe umożliwiają selektywne tłumienie sygnału


